12月16日,欧洲药品管理局(EMA)人用药品委员会(CHMP)结束了本年度最后一次工作会议,本次会议对6个新药的欧盟上市申请出具了审评意见。至此,CHMP全年一共完成92款新药上市申请的审评,对其中89款新药给与了积极意见(文末附表)。总体上,2022年CHMP推荐上市新药总数相较2021年有所下降,但其中全球首批新药数量仍稳中有升。
全球首批新药情况
CHMP本年度推荐上市的新药中,包含8款全球首批新药,其中7款为生物技术药物,包括2款基因治疗药物、1款细胞治疗药物、3个抗体类药物以及1个蛋白类药物,化药小分子药物占据另一席(表1)。
表1:2022年度CHMP推荐上市全球首批新药
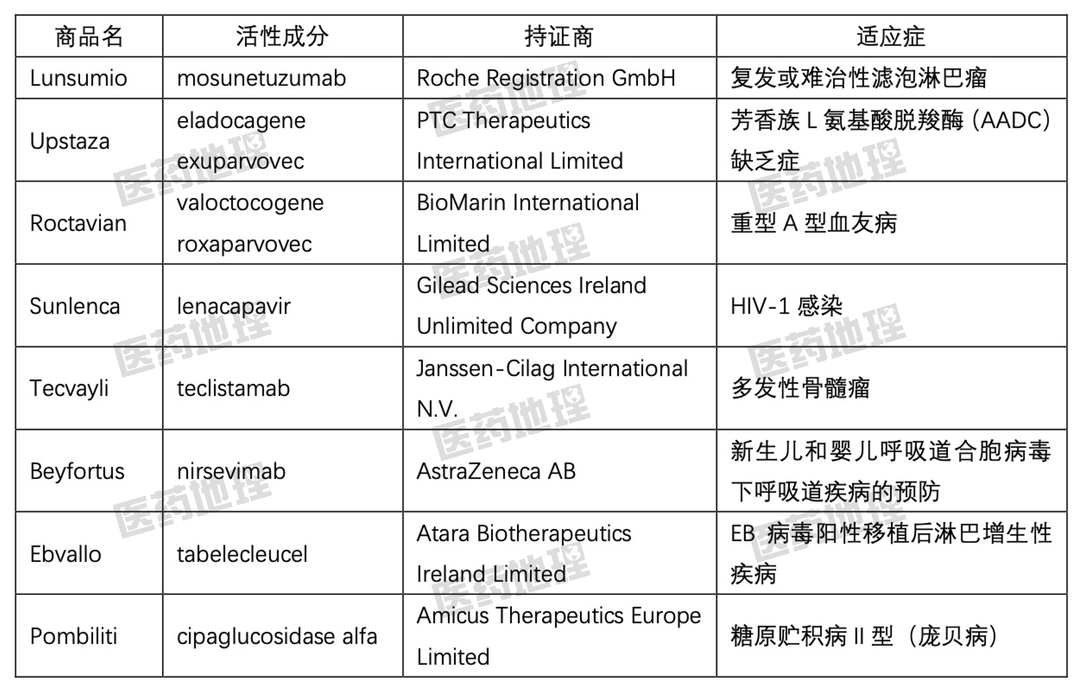
双特异性抗体被视为肿瘤治疗的第二代抗体疗法,在2022年似乎迎来了“爆发”期。CHMP本年度推荐上市的抗体药物中,包括了3个双抗药物,其中两个为全球首批的first-in-class产品,分别为罗氏公司开发的CD20 x CD3靶向双特异性抗体Lunsumio (mosunetuzumab)以及强生公司开发的首个全人源化BCMA x CD3 靶向双特异性抗体Tecvayli(teclistamab)。以上两款药物为不同类型的多次复发性或难治性血液肿瘤患者带去了福音。
欧盟首批新药情况
除去仿制药(generic medicine)、生物类似药(biosimilar medicine)和改良型新药(hybrid medicine),CHMP本年度共推荐上市新药51款,分布涉及14个治疗领域。其中,抗肿瘤药排名仍然第一,约占总数的1/3,所针对适应症包括血液系统肿瘤、前列腺癌、肺癌、肝癌、眼肿瘤、尿路上皮癌等。抗感染用药排名第二,有9款新药获得推荐,包括4款疫苗。消化道系统用药排名第三,有5款药物获得推荐。此TOP3治疗领域合计占比将近60%(图1)。
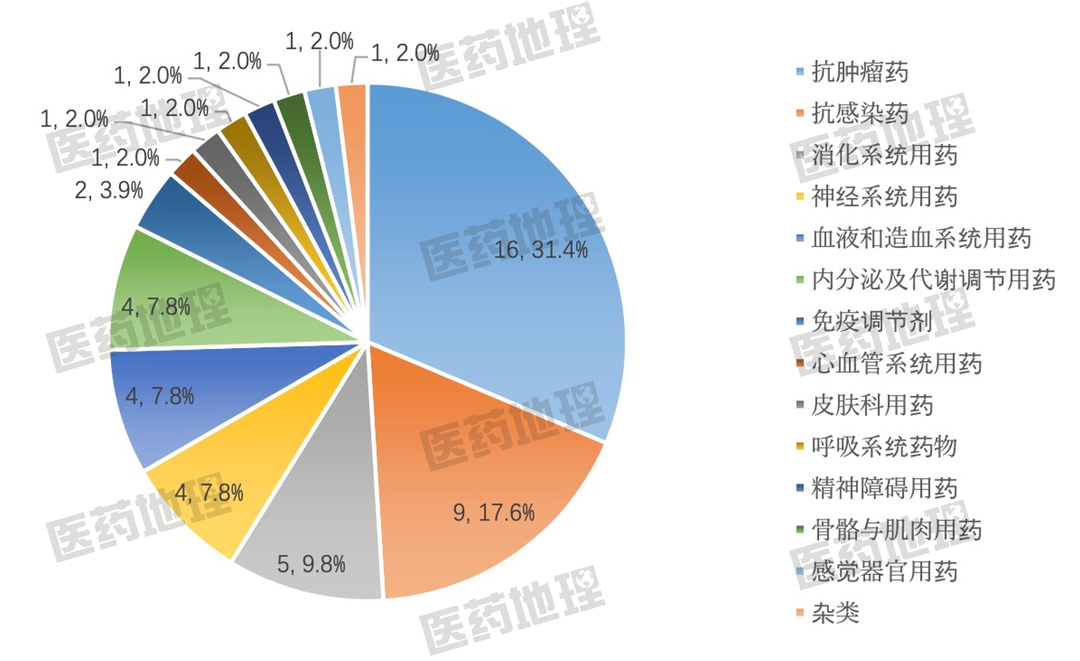
图1:2022年度CHMP推荐上市新药治疗领域分布
研发企业方面,AstraZeneca AB和Novartis无疑是本年度的大赢家,分别各有4款新药获得推荐,并列第一。此外,包括Roche、Eli Lilly、Janssen-Cilag、Takeda、Genzyme Europe BV、 Bristol-Myers Squibb等巨头们在内的7家公司,分别有2款新药获得推荐,并列第二。其它29家公司则分别为欧盟市场贡献了一款新药。
附:2022年欧盟CHMP推荐上市新药

