2023年上半年药审中心受理总量为8266个,2023年上半年共11个化药1类新药,1个中药1类新药和14个生物制品1类新药获批上市,2023年上半年525个按仿制药质量和疗效一致性评价申报获受理,2023年上半年34个品种纳入优先审评程序,24个品种纳入突破性治疗审评程序。
2023年上半年各注册申请类型申报情况
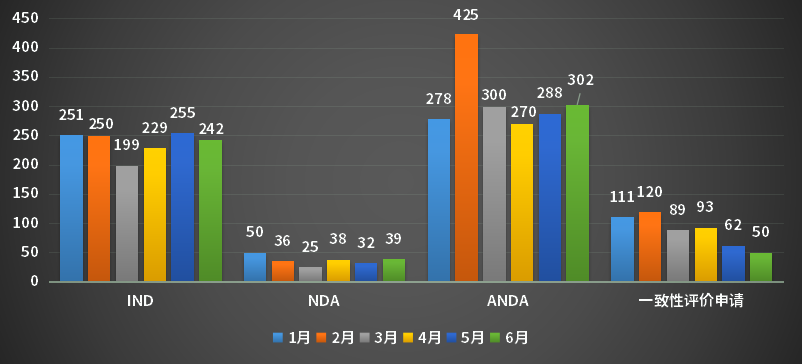
2023年上半年CDE受理申请以注册申请类别统计,受理新药临床试验申请(以下简称IND)受理号1426个;新药上市许可申请(以下简称NDA)受理号220个;同名同方药、仿制药、生物类似药上市许可申请(以下简称ANDA)受理号1863个;仿制药质量和疗效一致性评价注册申请(该注册申请类别以下简称一致性评价申请)受理号525个;2023年1-6月各申请类别注册申请受理量。
2023年上半年创新药注册申请受理情况
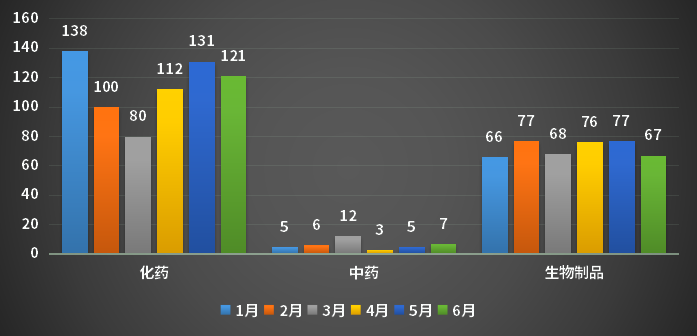
2023年上半年CDE受理1类创新药申请受理号1151个,涉及抗肿瘤、抗感染等多领域;其中,化药申请682个,中药申请38个,生物制品申请431个;2023年1-6月1类创新药申请受理情况。
受目前市场环境和相关政策的引导,2023年上半年中药申报的受理号数量相比2022年同期有较大增长,在2023年上半年CDE共承办新的中药注册申请有1265个;以审评任务类别统计,IND申请44个,NDA申请10个,ANDA申请1个;2023年上半年新承办的中药上市申请。

2023年上半年生物制品创新药批准情况
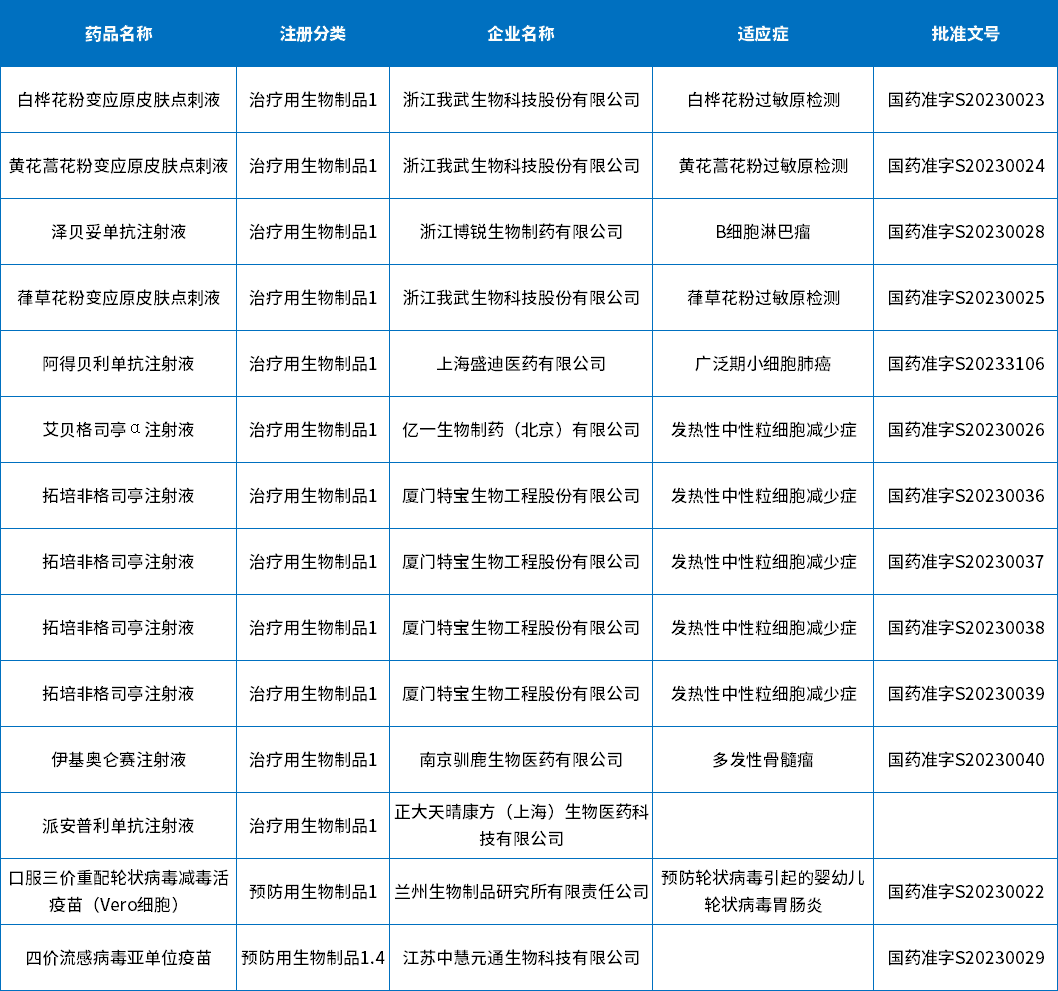
2023年上半年CDE共审评完结生物制品受理号986个,其中1类创新药受理号386个;其中IND申请371个,有批准临床结论的328个,涉及晚期实体瘤、非小细胞肺癌等适应症;NDA申请15个,14个批准上市和1个未被批准;2023年上半年批准上市1类生物制品创新药。
化药完成审评情况
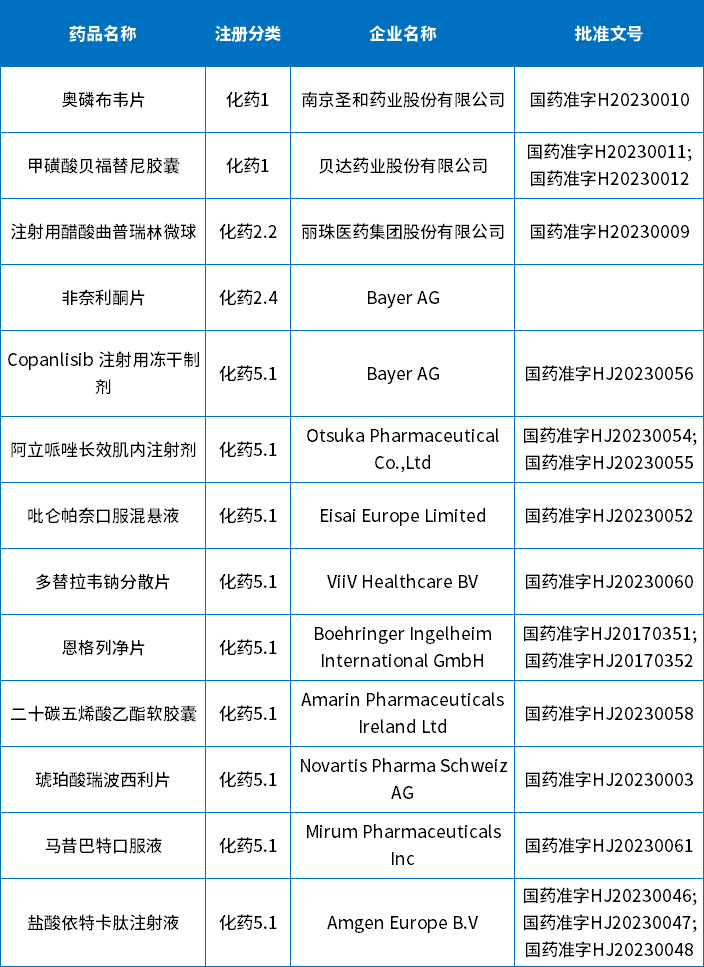
5月批准的新药和进口原研共13个,包括:2个1类新药、2个2类新药和9个进口原研批准上市;下表为5月化药获批新药和进口原研信息。
奥磷布韦片
奥磷布韦片是南京圣和药业自主研发并拥有自主知识产权的1类创新药,是国内首个拥有自主知识产权的NS5B抑制剂,适用于与盐酸达拉他韦联用,治疗初治或干扰素经治的泛基因型成人慢性丙型肝炎病毒(HCV)感染,可合并或不合并代偿性肝硬化。该药品的上市为成人慢性丙型肝炎病毒患者提供了新的治疗选择。
甲磺酸贝福替尼胶囊
甲磺酸贝福替尼胶囊是贝达药业申报的1类创新药,是第三代表皮生长因子受体酪氨酸激酶抑制剂,能够选择性地抑制EGFR敏感突变和EGFR T790M耐药突变激酶,该药适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂治疗出现疾病进展,并且伴随EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌患者的治疗。该药品的上市为非小细胞肺癌患者提供了新的治疗选择。
化药仿制药获批情况
5月共98个化药仿制药批准上市(按药品名+企业维度统计,排除了“氧”的数据统计),其中包括3类仿制药的14个,4类仿制药的77个,进口5.2类7个;ATC分类包括:心血管系统、神经系统等(仿制药获批具体信息请关注药智数据企业版——药品注册与受理数据库)。
生物制品完成审评情况
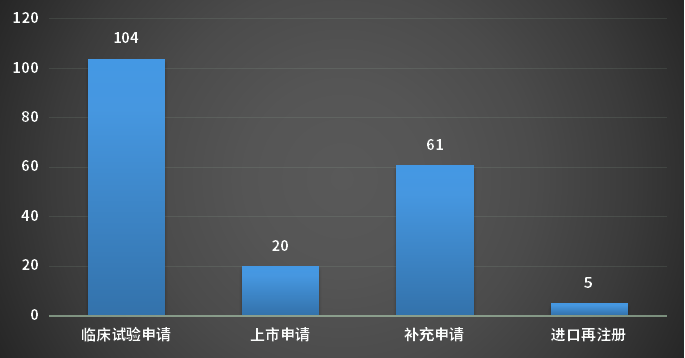
5月份CDE完成审评的生物制品注册申请196个(以受理号计),其中新药申请受理号98个,进口受理号26个,补充申请61个;以审评任务类别统计(以受理号计),临床试验申请104个,上市申请20个;2023年5月CDE生物制品各审评任务类别完成审评情况。
我国已成为全球新药研发的理想之地
临床试验组长单位主要分布广东、北京、上海、江苏等经济发达地区的省会城市,省份之间、省市内部分布不均衡,这与我国优质医疗资源主要集中于一、二线大中城市的现状有关。2019年,临床试验机构资质从认证制改为备案制后[9],虽然全国临床试验机构持续增长,至2022年4月13日临床试验机构达1185家,与备案制实施前相比增长率为33.7%[10];但从各省临床试验机构数量上看,广东、江苏、北京分别占总数的8.7%、7.8%和6.0%,临床试验地域分布仍然不够均衡。国内新药临床试验集中于北京、江苏和上海的机构。
对于临床试验申办方,以恒瑞医药为代表的国内制药企业研发实力迅速提升,在临床试验数量和产品数量上均超过了国外制药企业。从申办方的地域分布上看,随着生物医药行业集中度不断提升,京津冀、长三角、粤港澳大湾区、成渝双城已成为我国生物医药产业集聚区,这与当地政府高度重视生物医药产业发展密不可分。
本研究系统地阐述了国内创新生物制品研发的总体格局,然而仍存在一定的局限性。首先,尽管药物临床试验在公示平台上登记具有强制性和时效性,这在很大程度上确保了数据的完整性和可靠性,但是2013年9月该公示平台才正式启用,此前的药物临床试验可能被省略了。其次,该公示平台数据仅纳入用于药品注册为目标的药物临床试验,未纳入研究者发起的临床试验研究。最后,本研究纳入的临床试验均基于公示日期,而药物临床试验的登记具有滞后性,因此可能与实际临床试验开展情况有所不同。
2013—2022年间,随着政府持续深化医药改革以及我国新药临床研发能力不断提升,我国已成为全球新药研发的理想之地。但是,如何优化临床资源配置、引导制药企业进行差异化的新药研发和保持新药研发可持续性,从而促进医疗创新,是一个值得决策者探索的重要问题。
来源:医药智投