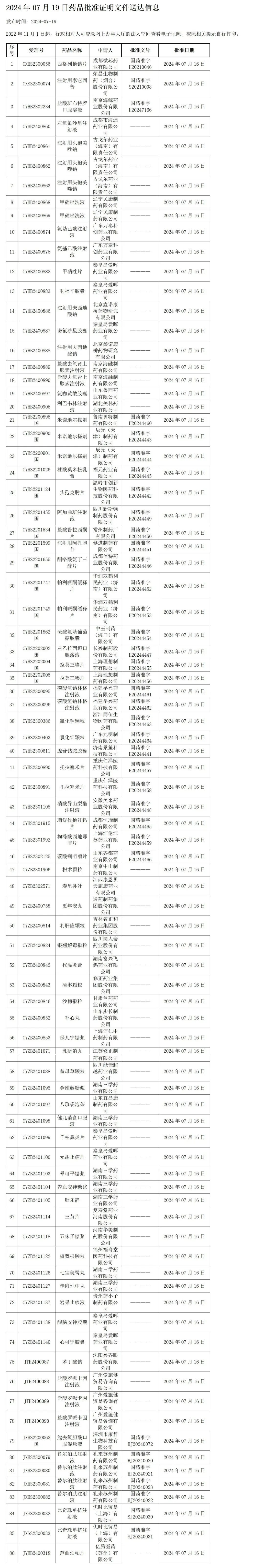
7月19日,NMPA发布药品批准证明文件送达信息,本批次共有86个受理号获批,其中12个为进口注册(包括3款新药),国内注册74个。
国产两款新药为成都微芯药业有限公司的西格列他钠片、荣昌生物制药(烟台)股份有限公司的注射用泰它西普。进口的3款新药分别为深圳市康哲生物科技有限公司的熊去氧胆酸口服混悬液、礼来苏州制药有限公司的替尔泊肽注射液、优时比贸易(上海)有限公司的比奇珠单抗注射液。
西格列他钠(Chiglitazar Sodium)是一种过氧化物酶体增殖物激活受体(PPAR)全激动剂,能同时激活PPAR三个亚型受体(α、γ和δ),并诱导下游与胰岛素敏感性、脂肪酸氧化、能量转化和脂质转运等功能相关的靶基因表达,抑制与胰岛素抵抗相关的PPARγ受体磷酸化。该药品是中国自主研发并拥有自主知识产权的创新药,单药适用于配合饮食控制和运动,改善成人2型糖尿病患者的血糖控制。2021年10月,国家药品监督管理局批准成都微芯药业有限公司申报的1类创新药西格列他钠片(商品名:双洛平/ Bilessglu)上市。2024年3月,微芯生物PPAR激动剂西格列他钠治疗非酒精性脂肪性肝炎(NASH)的Ⅱ期临床(CGZ203研究)达到了主要终点。与安慰剂相比,西格列他钠(48mg、64mg)治疗18周后患者经磁共振质子密度脂肪分数(MRI-PDFF)评估的肝脏脂肪含量(LFC)较基线的降幅更多,具统计学意义;肝脂肪含量下降超过30%的患者比例等次要终点指标也显著改善。此外,药物总体耐受性良好。
泰它西普(RC18,商品名:泰爱®)是荣昌生物制药研发的用于治疗自身免疫性疾病的新型融合蛋白,由人跨膜激活剂及钙调亲环素配体相互作用因子(TACI)受体的胞外域以及人免疫球蛋白G (IgG)的可结晶片段(Fc)域构成。泰它西普靶向两类对B淋巴细胞发育至关重要的细胞信号分子:B淋巴细胞刺激因子(BLyS)和增殖诱导配体 (APRIL),得以有效降低B细胞介导的自身免疫应答,自身免疫应答与多种自身免疫性疾病有关。
tirzepatide(LY3298176) 替尔泊肽是由礼来开发的一种新型每周一次的葡萄糖依赖性促胰岛素多肽(GIP,又名:胃抑制多肽)受体和胰高血糖素样肽-1(GLP-1)受体双重激动剂。2021年10月,礼来向FDA递交了Tirzepatide新药上市申请(BLA),用于每周1次皮下注射给药治疗血糖控制不佳的2型糖尿病。Tirzepatide的适应症开发已涉及糖尿病、肥胖症、肾病(CKD)和睡眠呼吸暂停(OSA)。2024年5月,礼来中国宣布穆峰达®(替尔泊肽注射液)获得国家药品监督管理局(NMPA)批准。该药是一种创新的每周一次的葡萄糖依赖性促胰岛素多肽(GIP)/ 胰高糖素样肽-1(GLP-1)受体激动剂,适用于在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物治疗血糖仍控制不佳的成人2型糖尿病(以下简称:T2DM)患者。
以下为完整名单: