3月2日晚间,上海阳光医药采购网发布《全国药品集中采购文件(GY-YD2023-1)》(以下简称《文件》),第八批国采官宣,共涉及40个大品种。
上述所有信息的公布均在:海南省陵水县光坡镇香水湾B区富力酒店北楼一层。

部分重点内容:
采购品种及约定采购量
( 一) 采购品种目录
本次药品集中采购品种 (以品种序号区分) ,首年约定采购量 计算基数、相应比例采购量汇总值 (单位:万片/万粒/万袋/万支等) 及最高有效申报价 (单位:元/片、粒、袋、支等) 。
(二) 约定采购量
1. 各地首年约定采购量及各采购品种首年约定采购量。
2.各品种各地首年约定采购量按以下规则确定:全国实际中选 企业数为 1 家的,为首年约定采购量计算基数的50%;全国实际中选 企业数为 2 家的,为首年约定采购量计算基数的60%;全国实际中选 企业数为 3 家的,为首年约定采购量计算基数的 70%;全国实际中选 企业数为 4 家及以上的,为首年约定采购量计算基数的80%。若那屈 肝素 (那曲肝素) 注射剂和依诺肝素注射剂的中选企业无预灌封包 装,则其首年约定采购量在上述带量比例的基础上再按 40%比例确定。
其中:阿莫西林克拉维酸口服常释剂型、阿莫西林克拉维酸注 射剂、氨曲南注射剂、奥硝唑注射剂型、复方磺胺甲噁唑口服常释 剂型、 甲硝唑注射剂型、利福平/利福平Ⅱ口服常释剂型、头孢地尼 颗粒剂、头孢西丁注射剂型、头孢地嗪注射剂,各地首年约定采购 量按以下规则确定:全国实际中选企业数为 1 家的,为首年约定采 购量计算基数的40%;全国实际中选企业数为 2 家的,为首年约定采
购量计算基数的50%;全国实际中选企业数为 3 家的,为首年约定采 购量计算基数的60%;全国实际中选企业数为 4 家及以上的,为首年 约定采购量计算基数的 70%。比阿培南注射剂、达托霉素注射剂、伏 立康唑注射剂、哌拉西林他唑巴坦注射剂、头孢哌酮舒巴坦注射剂、 头孢噻肟注射剂,各地首年约定采购量按以下规则确定:全国实际 中选企业数为 1 家的,为首年约定采购量计算基数的30%;全国实际 中选企业数为 2 家的,为首年约定采购量计算基数的40%;全国实际 中选企业数为 3 家及以上的,为首年约定采购量计算基数的50%。
(三) 同品种不同规格和不同组方配比的约定采购量折算规则。
拟中选企业确定
11.入围企业确定准则
11.1 采购品种目录中同品种最多入围企业数根据符合“申报品 种资格”的实际申报企业数确定,见下表:

11.3 同品种申报企业“单位可比价”相同时,按以下规则依次 确定:
11.2 符合 6.4 要求的企业申报价, 以采购品种目录中同品种最 小规格作为代表规格,按药品差比价规则折算至最小计量单位后的 价格作为“单位可比价” 。按“单位可比价”由低到高确定申报企 业入围及供应地区确认的顺序,“单位可比价”最低的为第一顺位, 次低的为第二顺位,依次类推确定其他顺位。
(1) 当前未被任意一省依据医药价格和招采信用评价制度评定 为“中等” 、“严重”或“特别严重”失信等级的企业优先;
(2) 2022 年省级供应地区数多的企业优先 (以各地报送数据为 依据) ;
(3) 2022 年在各地销售量大的企业优先,多个规格的品种, 销售量合并计算 (以各地报送数据为依据) ;
(4) 通过或视同通过国家药品监督管理部门仿制药质量和疗效 一致性评价时间在前的企业优先 (以国家药品监督管理部门批准日 期为准) ;
(5) 原料药自产的企业优先 (限指原料药和制剂生产企业为同 一法人) 。
(6)承诺供应国内市场产能较大的企业优先(产能以企业在“国 家组织药品集中采购综合服务平台”中承诺且提交的产能为依据) 。
11.4 申报同品种的不同企业,存在以下情形的,涉及企业中仅 “单位可比价”最低且居于入围企业非末位的获得入围资格:
11.4.1 企业负责人为同一人或存在直接控股、管理关系等情形;
11.4.2 包括但不限于工业和信息化部《2021 年中国医药统计年 报》化学制药分册中“化学药品工业企业法人单位隶属关系后注” 确认的企业关系的情形 (有相关文件证明企业间关系已改变的情况 除外) ;
11.4.3 企业之间存在该品种部分有效注册批件转让的情形。
11.4.4 企业之间就该品种存在境外药品上市许可持有人境内代 理人关系的情形。
11.5 申报同品种的不同企业,存在以下情形的,涉及企业中居 于入围企业非末位的获得入围资格:
11.5.1 除 11.4.3 情形外,企业将该品种委托给其他申报企业生 产的情形;
11.5.2 企业将该品种委托给其他企业生产,该受委托生产企业 与该品种其他申报企业存在 11.4.1、11.4.2 情形。
11.6 同品种入围企业根据最多入围企业数及申报企业顺位确定。
12.拟中选企业确定准则
入围企业同时满足情形一和情形二的,获得拟中选资格。
情形一:价格符合以下条款之一
12.1“单位可比价”≤同品种最低“单位可比价”1.8 倍的。12.2“单位可比价”≤0.1000 元的。
12.3“单位申报价”降幅≥50%的 (降幅以《采购品种目录》对 应规格最高有效申报价为基数进行计算,以百分比计) 。
情形二:满足情形一的入围企业,符合以下条款之一 12.4 满足情形一后, 同品种中非最高顺位的。
12.5 满足情形一后, 同品种中为最高顺位,按“同品种最高顺 位‘单位可比价’/同品种最低顺位‘单位可比价’”计算比值,在 本次集采所有品种比值结果降序排列中非前 6 名的。若与第 6 名计 算比值相等,则并列第 6 名。
供应地区确认
13.供应地区确认准则
13.1 拟中选企业统一进行主供地区和备供地区确认。若拟中选 企业未按时参与供应地区确认,视同放弃拟中选资格。
13.2 主供地区确认。拟中选企业首先进行主供地区确认程序, 第一顺位企业优先在供应地区中选择 1 个地区。优先选择完毕后, 从第一顺位企业开始,所有拟中选企业按顺位依次确认剩余地区, 每个拟中选企业每次选择 1 个地区,重复上述过程,直至所有地区 选择确认完毕。
13.3 备供地区确认。拟中选企业在主供地区确认完毕后,进行 备供地区确认程序。每个拟中选企业的备供地区须不同于其主供地 区。若拟中选企业数为 1 家,则无需参加备供地区确认。
13.3.1 第一顺位企业优先在供应地区中选择 1 个地区。
13.3.2 优先选择完毕后,从第一顺位企业开始第一轮的选择, 所有拟中选企业按顺位依次确认备供地区,每个拟中选企业每次选 择 1 个地区,第一轮结束后开始第二轮, 以此类推,直至所有地区 选择完毕。每个拟中选企业只能从其他拟中选企业的主供地区中选 择其备供地区。根据拟中选企业数确定轮次数,为确保备供地区选 择顺利进行,设置“选择单元” ,若拟中选企业数为N 家 (N≥2) , 则每个“选择单元”由 N-1 轮组成 (具体见下表) 。
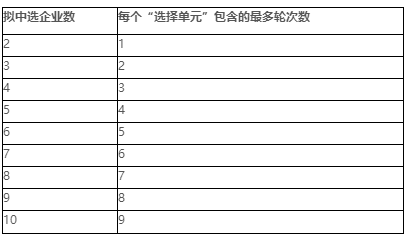
13.3.3 一个“选择单元”内每个拟中选企业在每一轮中须从不 同拟中选企业的主供地区中选择其备供地区,即一个“选择单元” 内每个拟中选企业不可从同一家拟中选企业的主供地区中选择其备 供地区。如遇到拟中选企业因不满足备供地区确认规则而不可选择 的情况,则该拟中选企业不得选择,顺延至下一顺位拟中选企业选择,直至所有地区选择完毕。
13.3.4 拟中选企业确认后在备供地区成为备供企业,备供企业 按其中选价格直接在备供地区挂网供应。当主供企业无法满足所选地区市场需求时,备供企业可按有关程序获得主供企业身份。具体 启动程序和条件由各省级医保部门负责。
13.4 拟中选企业若当前被任意一省依据医药价格和招采信用评 价制度评定为“严重”或“特别严重”失信等级的,或在两年内拟 中选企业在国家组织药品集中采购中的中选品种被联合采购办公室 取消中选资格的,在主供和备供地区确认中,均不具备拟中选企业 第一次选择确认地区的资格。
13.5 拟中选企业应结合本企业产能确认供应地区,轮到选择时, 在满足地区确认规则的情况下必须做出确认,不得弃权,否则视同 放弃拟中选资格, 由其他拟中选企业按顺位重新依次确认供应地区。 供应地区确认完毕后,联合采购办公室即与拟中选企业签订备忘录。
13.6 当拟中选企业在所选省份存在以下情形时,被选省份有权 拒绝该企业的选择:
13.6.1 拟中选企业当前被该省份依据医药价格和招采信用评价 制度评定为“严重”或“特别严重”失信等级的。
13.6.2 拟中选企业在省级或省际联盟的药品集中带量采购中选 后拒绝在该省签订采购协议,或拒绝在该省履行协议的。
13.7 第二备供企业确认。氨甲环酸注射剂型、丙戊酸钠注射剂、 那屈肝素 (那曲肝素) 注射剂、依诺肝素注射剂和呋塞米注射剂等 5 个品种,若同品种中选企业数≥3 家,在中选企业主供地区和备供地 区确认后, 由各省医保部门从同品种中选企业中再选择一家第二备 供企业,第二备供企业须不同于本省的中选企业和备供企业。
中选药品确定
14.注射剂价格计算
拟中选注射剂的申报价按药品差比价规则折算至最小计量单位 (指单瓶/单袋/单支等) 时,若价格出现小数点后 2 位以上的,则 采用舍去法只保留 2 位小数,以此价格重新计算“申报信息一览表” 中的拟中选价格,并进行公示。
15.拟中选结果公示
拟中选结果在“上海阳光医药采购网” (www.smpaa.cn ) 公示, 并接受申投诉。申投诉应在公示期间提出,并依法依规提供合法有 效证据材料;未提供相应证据材料或公示期结束后提出申投诉的, 联合采购办公室原则上不予受理。经公示,如拟中选企业被取消中 选资格的,所涉品种不递补拟中选企业,该企业所选省份可由 13.3 确定的备供企业作为替补的供应企业。
16.中选通知
拟中选结果公示无异议后,联合采购办公室将发布中选通知。
17.药品购销协议
17.1 各地在联合采购办公室发布中选通知后,按照当地中选药品及其中选价格在省级药品集中采购平台上完成挂网工作,按要求组织签订购销协议并执行。
17.2 购销协议签订后,采购方与中选企业不得再订立背离协议 实质性内容的其他协议或提出除协议之外的任何利益性要求。
17.3 购销协议必须如实反映实际供应价格和采购量,采购方应 根据协议的约定及时回款,不得拖欠。
18.中选药品挂网价格确定
中选企业在主供地区、备供地区按其中选价格直接挂网供应, 在第二备供地区按不高于其中选价格的 1.5 倍或同品种最高中选价 挂网供应,在非主供和非备供地区也按不高于其中选价格的 1.5 倍 或同品种最高中选价挂网供应。
违约及处置
19.申报企业、中选企业、配送企业如有以下行为,经有关部门认定情节严重的将被列入“违规名单”
19.1申报品种不符合“申报品种资格”或涉嫌不如实提供材料。
19.2提供处方回扣或其他商业贿赂,进行非法促销活动。
19.3以低于成本的价格恶意申报,扰乱市场秩序。
19.4相互串通申报、协商报价,排斥其他申报企业的公平竞争,损害采购方或者其他申报企业的合法利益。
19.5以向采购方、联合采购办公室行贿等手段牟取中选。
19.6提供虚假证明文件及文献资料,或者以其他方式弄虚作假,骗取中选。
19.7在规定期限内不签订购销协议。
19.8未按采购方及法律法规要求实行配送。
19.9拟中选或中选后放弃中选资格。
19.10不履行供货承诺,影响到临床使用。
19.11中选药品发生严重质量问题。
19.12中选药品因不符合药品生产质量管理规范被药品监督管理部门处以暂停生产、销售、使用、进口等控制措施。
19.13在抽检或飞行检查中发现中选企业严重违背在申报材料中作出的承诺。
19.14恶意投诉的企业。
19.15蓄意干扰集中采购相关工作秩序。
19.16其他违反法律法规的行为。
20.列入“违规名单”的相关企业,由各地按以下条款处理
20.1申报企业列入“违规名单”的,取消该企业的申报资格;中选企业列入“违规名单”的,取消该企业的中选资格。同时视情节轻重取消上述企业或品种在列入“违规名单”之日起2年内参与各地药品集中采购活动的资格。
20.2配送企业列入“违规名单”的,取消该企业的配送资格及列入“违规名单”之日起2年内参与各地药品集中采购的配送资格。
21.鼓励相关企业在集采过程中积极主动提供围标、串标、弄虚
作假等证据,经查证属实,提供证据的企业若涉及医药企业信用失信的,其失信自动修复时限可相应缩短。
22.替补机制
22.1中选品种出现被药品监督管理部门采取暂停生产、销售、使用、进口、责令召回等措施的,取消中选资格。
22.2中选企业出现中选品种不能及时足量供应或取消中选资格等情况,致使协议无法继续履行时,所在省份可由13.3确定的备供企业供应相应的中选品种。当13.3确认的备供企业不能满足供应需求时,所在省份可启动增补备供企业供应流程。增补的备供企业从该品种其他中选企业中确定,该品种按增补的备供企业中选价格进行供应。
22.3采购周期内,若中选药品配送企业被列入“违规名单”,各地应及时处理,组织中选企业选择其他配送企业,确保中选药品及时配送。